诺华阿曲生坦获FDA加速批准,成为治疗IgA肾病的新药


4月3日,诺华宣布其新型药物阿曲生坦(atrasentan,商品名Vanrafia)获得美国食品和药品管理局(FDA)的加速批准。此药物被批准用于降低患有疾病进展风险的成人原发性免疫球蛋白A肾病(IgAN)患者的蛋白尿。这使得阿曲生坦成为首个被批准用于减少IgA肾病蛋白尿的选择性内皮素A受体(ETA)拮抗剂。

诺华收购Chinook,进一步布局IgA肾病治疗
2023年,诺华以35亿美元收购了Chinook公司,获得了包括阿曲生坦在内的多个治疗IgA肾病的创新药物。这一收购为诺华的肾病领域带来了巨大的市场潜力,尤其是在IgA肾病这一全球常见的肾脏疾病领域。
阿曲生坦在治疗IgA肾病的III期ALIGN研究中取得了积极成果,在36周期的研究中成功达成主要疗效终点,显著降低了患者的蛋白尿水平,这为药物的上市提供了坚实的临床数据支持。
基于ALIGN研究的数据获得FDA加速批准
阿曲生坦的FDA加速批准基于ALIGN研究中的预设中期分析结果。尽管该药物成功减少了IgA肾病患者的蛋白尿,但是否能够有效延缓患者肾功能衰退尚未确定。因此,阿曲生坦是否能够继续获得长期批准,仍将取决于进一步验证其临床获益的研究成果。预计在2026年,ALIGN研究的136周数据将提供关于阿曲生坦对IgAN患者肾功能保护作用的更全面评估。
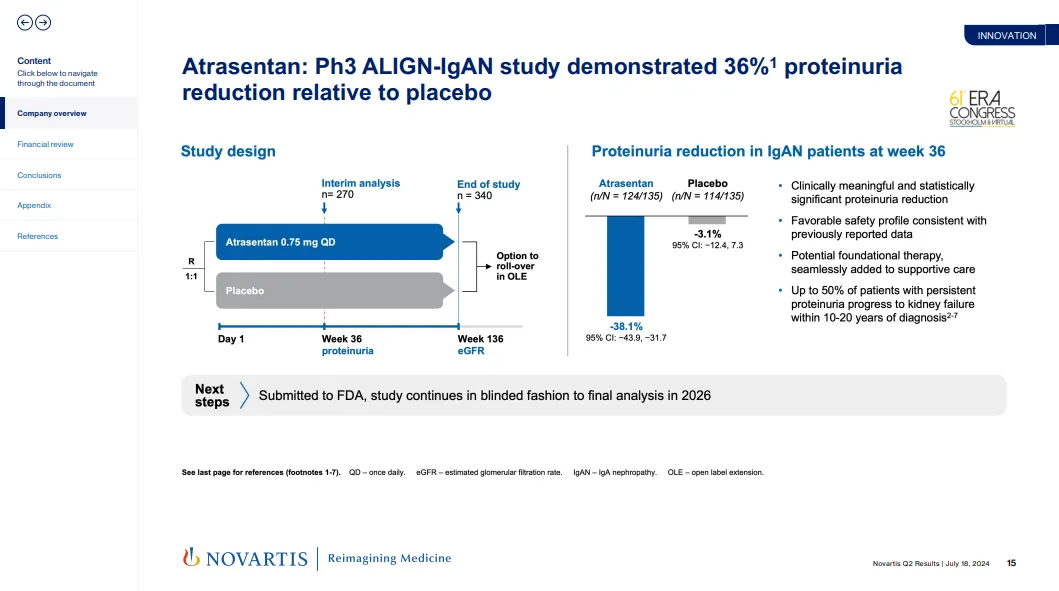
IgA肾病的严重性与阿曲生坦的潜力
IgA肾病是一种由免疫球蛋白A(IgA)免疫复合物在肾小球系膜区沉积引起的肾小球疾病。它是全球最常见的原发性肾小球肾炎之一,尤其在年轻人中高发,并且是导致慢性肾病和肾衰竭的主要原因之一。
阿曲生坦的获批为IgA肾病患者带来了新的治疗希望,尤其是在该病症没有特效治疗药物的背景下,其作用无疑具有重要意义。
阿曲生坦在中国获优先审评
阿曲生坦在中国的上市申请也正在积极推进,并且已经获得了优先审评。据估计,每年全球每百万人中约有25人被诊断为IgA肾病,而中国的IgA肾病发病率位居全球之首。因此,阿曲生坦的上市对于中国患者而言,具有重要的临床意义。
诺华肾病领域的持续创新
随着阿曲生坦的获批,诺华在肾病治疗领域的布局进一步丰富。2024年8月,诺华推出了针对补体旁路途径的首个补体因子B(CFB)抑制剂——伊普可泮,并获得FDA批准用于治疗IgA肾病。2025年3月,伊普可泮还获得FDA批准用于治疗C3肾小球病(C3G),成为全球首个获批的C3G治疗药物。
展望未来:肾病治疗的新篇章
随着阿曲生坦和其他创新药物的推出,诺华在肾病领域的持续创新为患者带来了更多的治疗选择。公司预计,随着这些药物的推广,全球数百万IgA肾病患者将能够受益于更有效、更精确的治疗,肾病领域的治疗水平有望迎来新的突破。
总结来说,阿曲生坦的加速批准为治疗IgA肾病提供了新的希望,也标志着诺华在肾病领域取得的重大进展。随着未来临床数据的不断积累,这一创新疗法有望为全球肾病患者带来革命性的治疗选择。














